Chloordioxide
Chloordioxide (ClO2) is een sterk desinfectans. Het wordt niet geklasseerd onder de “chloor desinfectans” omdat de werking verschillend is van die van chloorgas en hypochloriet. Er wordt geen vrij chloor geproduceerd, maar wel chloriet (ClO2-) en chloraat (ClO3-) (Verbeeck, 2008).
Het chloordioxide valt de elektronrijke kern van organische moleculen aan. Daarbij wordt een elektron overgedragen en ontstaat chloriet:
ClO2 + e- 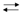 ClO2-
ClO2-
ClO2- + 4 H+ + 4 e- 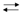 Cl- + 2 H2O
Cl- + 2 H2O
Voordelen
- in tegenstelling tot chloor, reageert chloordioxide niet met ammoniak en nauwelijks met andere stikstofverbindingen, zodat er geen trichlooramines gevormd worden;
- in basis milieu (pH 9) heeft chloordioxide zijn optimale werking en is het veel efficiënter dan chloor in zijn optimaal pH-gebied. In het neutraal milieu (pH 7) blijkt chloor dan toch efficiënter te zijn voor de desinfectie van virussen (Taylor & Butler, 1982).
Nadelen
- er worden schadelijke chlorieten en chloraten gevormd. Verschillende landen hebben dan ook een maximum norm voor chloriet (in drinkwater);
- in hoge concentraties kan chloordioxide tranende ogen, irritaties of brandwonden veroorzaken. Wanneer het door de huid wordt opgenomen kan het schade veroorzaken aan weefsels en bloedcellen. Het gas kan ook leiden tot keel- en hoofdpijn. De effecten op de ontwikkeling van foetussen is nog onvoldoende bestudeerd;
- chloordioxide onder druk is explosief en daarom onveilig om te transporteren. Het wordt daarom meestal ter plaatste geproduceerd. De basisproducten zijn natriumchloriet (NaClO2) of natriumchloraat (NaClO3), en zoutzuur (HCl) of chloor (Cl);
- hoge kostprijs omwille van de hoge kosten voor de productie ter plaatste (5 à 10 maal duurder dan chloor).
